コロナウィルス感染症COVID-19は全世界で猛威を振るっており,世界各国で治療薬・ワクチンの開発が急がれている.本稿執筆時点(2020年5月26日)において,米国では連邦政府が支援する34件を含む1,673件の治験や臨床研究が進められている*1.
治療薬ではウィルス感染を防ぐことはできないが,感染者の重症化や致死率を下げるために必要であり,ワクチン開発後の需要も期待できる.治療薬は主に「ドラッグリポジショニング」による既存薬の評価が進められている.「ドラッグリポジショニング」とは,ヒトでの安全性・体内動態が十分に証明されて既に疾患治療薬として認可された医薬品,または一部の開発中止品の新しい薬理効果を発見し,その化合物を別の疾患治療薬として開発(適応拡大)することである*2.医薬品の安全性に関する要求水準が格段に高くなり,新薬開発が停滞する中で,動物実験データでヒトでの臨床効果を予測していく従来型の医薬品開発戦略は,見直しを迫られてきた.「ドラッグリポジショニング」を含めた取り組みの結果として,米国医薬食品局(FDA)が2019年に承認した48医薬品のうち21品目は,疾患モデル動物の作製が困難とされている希少疾病用の医薬品が占め,難治性疾患の治療の幅は広がりを見せるようになった.また,2014年から下落してきた新薬当たりのピーク時予想売上高も,昨年からは回復基調にある*3.ただ残念なことに,本来,科学やビジネスの観点から論理的・合理的に適応拡大されるはずの「ドラッグリポジショニング」戦略が,COVID-19という緊急事態において,なし崩し的に治療薬の探索に導入され始めた.最新の研究手法を用いて既存薬の特性を網羅的に徹底的にプロファイリングするには,数年を要することもある.拙速な治療薬承認は避けるべきではあるものの,社会の期待に応えるべく薬事規制が緩和され始めたことも相まって,転用できそうな既存薬が片っ端から試されているのが実情である.例えば,米国でGilead Sciences社がエボラ出血熱の治療で開発中であったレムデシビル(ベクルリー)は,日本においても2020年5月7日,いち早く承認された.とりわけ日本では,インフルエンザ治療薬のファビピラビル(アビガン)にかかる期待は大きい.本コラムでは,ポストコロナ時代に向けて,米国で話題となっている「ドラッグリポジショニング」によるCOVID-19治療薬候補と,日本発の候補化合物を紹介する.
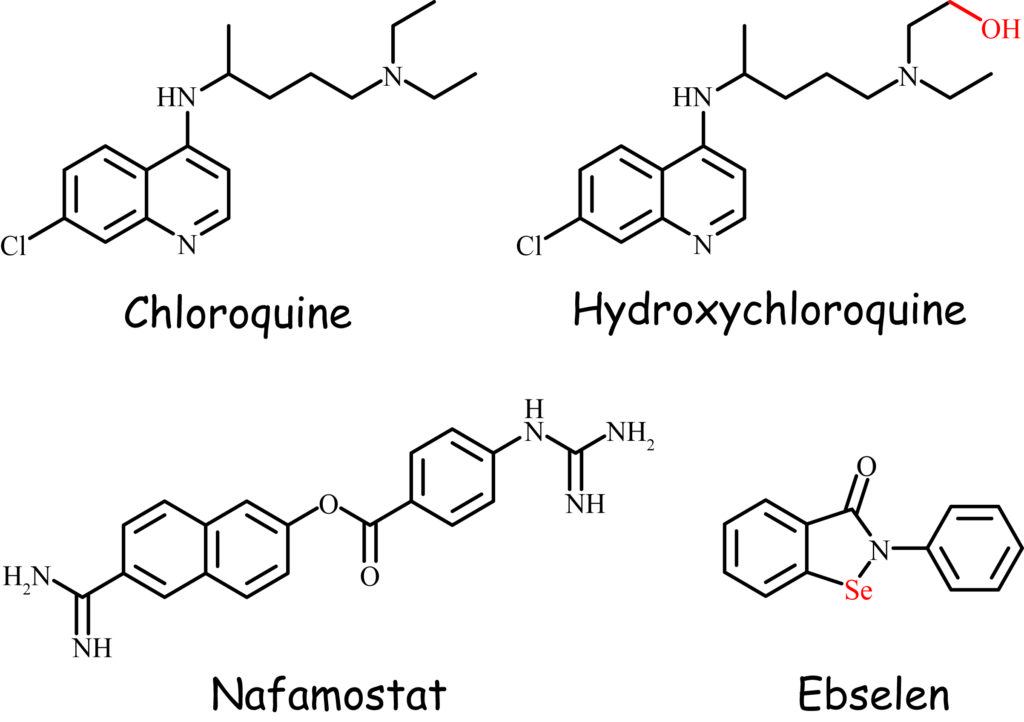
クロロキン・ヒドロキシクロロキン
クロロキン(CQ)は70年以上前に開発された古い抗マラリア剤であり,慢性腎炎,リウマチ様関節炎,全身性エリテマトーデスなどの治療でも長期間にわたって投与された.日本では1955年に上市されたが,角膜・網膜に対する副作用が強く,特に網膜障害は不可逆的に色素沈着から網膜の変性を惹起し,視力低下や色覚異常を経て失明に至るおそれがあることから,1967年に日本薬局方から削除された*4.ヒドロキシクロロキン(HCQ)はCQの側鎖末端の酸化代謝物であり,皮膚性/全身性エリテマトーデスの標準的治療薬として使われている.HCQは単剤または抗生物質アジスロマイシンなどとの併用でCOVID-19治療での効果が期待され,大規模な臨床試験が行われており,過去データに遡っての観察的研究やレビューを含む200報以上の論文が公表されている.LANCET誌に掲載された解析症例数が多い報告として,診断後48時間以内に治療を開始した96,032名(CQ群1,868名,CQ抗生物質併用群3,783名,HCQ群3,016名,HCQ抗生物質併用群6,221名,対照81,114名)のうち10,698名が死亡した計671病院の調査結果がある.この研究では,対照群の致死率は9.3%であったのに対し,CQ群16.4%,CQ抗生物質併用群22.2%,HCQ群18.0%,HCQ抗生物質併用群23.8%となり,治療投与により致死率が高くなることが示された.また,急性の心臓毒性(心室性不整脈)のリスクを高めることも指摘されている*5.
CQのCOVID-19治療薬としての作用メカニズムは完全には解明されていないものの,細胞内のリソソーム(細胞内の異物を加水分解する酸性の小器官)のpHを上昇させて機能低下をもたらし,リソソーム内にリン脂質を蓄積させてしまう作用はよく知られている(ホスホリピドーシス).医薬品の開発初期における毒性スクリーニングでは,CQやHCQなどを陽性対照に設定し,それより安全な医薬品候補化合物を積極的に探索するフローを取り入れている製薬企業が多い.長く使われているものが必ずしも安全な医薬品とは言えない中,「ドラッグリポジショニング」という再評価の機会に芳しい臨床試験成績を残せていない治療薬候補であるが,トランプ米大統領が予防的に服用していることを明言した(2020年5月18日)ことで一躍話題となっている.FDAの正式な見解が待たれる治療薬候補である.
ナファモスタット
ナファモスタット(フサン)は鳥居薬品が1986年に上市したセリンプロテアーゼ阻害剤で,急性膵炎の症状改善のために点滴静注されている.上気道から下気道にわたる気道全域の上皮細胞に発現している膜貫通型セリンプロテアーゼTMPRSS2が,呼吸器ウィルスの増殖に寄与するとする報告があり*6,COVID-19でもウィルスが糖タンパクを介してヒト細胞膜上のアンジオテンシン変換酵素2(ACE-2)に結合した後,TMPRSS2で活性化して細胞に侵入することが明らかとなった*7.TMPRSS2を阻害するナファモスタットや類薬の経口剤カモスタット(フオイパン)は,感染メカニズムの点からは有望な治療薬の候補になると考えられている.本稿執筆時点(2020年5月26日)において,ナファモスタットはイタリアで1件,カモスタットは海外で4件(うち2件は前述のHCQとの併用)の臨床試験が予定または実施されている.
エブセレン
エブセレンは第一製薬(現・第一三共)が急性期脳梗塞の治療薬として開発していた化合物*8で,化学構造内に元素のセレン(34Se)を含んでいる.日本で第III相臨床試験が終了したものの,2003年7月に承認申請は取り下げられて医薬品とはならなかったが,2019年4月まで米国Sound Pharmaceutical社において騒音性難聴やメニエール病の治療薬候補として開発は続けられていた.セレンは周期表では硫黄の下にある非金属で,生命維持には欠かせない微量の必須元素であり,実験室で細胞培養するときですら,亜セレン酸の形で培地に添加されている.エブセレンには強い殺菌効果があり,医療関連感染として問題となるMRSAやVRSAにも著効*9で,抗真菌活性が高く*10,COVID-19でもウィルスの3C様プロテアーゼのシステイン残基と結合して複製・転写を防ぐことが報告された*11.
セレン含有化合物には毒性の強いものがあり,安全域が狭いとする意見もあって,日本では毒劇物取締法で毒物に指定されている.ところが,二硫化セレン(SeS2)のように,医療制度で必要とされる最も効果的で安全な医薬品としてWHO必須医薬品モデル・リストに登録され,海外で化粧品やフケ防止シャンプーに配合されるものもある.エブセレンは,体内で過酸化物などの酸化ストレスから生体を保護するグルタチオンペルオキシダーゼのアナログ(模倣体)として開発が進められた経緯があり,過去の臨床試験におけるエブセレン投与後の血中総セレン濃度は,COVID-19に有効とされる濃度の約3倍を呈している*12ことから,忘れられるには惜しい良薬の可能性を秘めている.
今後もCOVID-19治療薬・ワクチンの治験や臨床研究は精力的に進められ,「ドラッグリポジショニング」による数多くの成功事例が期待される.ただ一方で,臨床試験の失敗例が出たとしても、事後に批判することは避けなければならない.—— 医薬品開発の最終ステージでは,医薬品候補化合物を実験動物に約2年間曝露し,催腫瘍性の可能性を明らかにする試験(がん原性試験)が行われる.試験の結果,ヒトに対するリスクが低いことが証明された場において,これまで顔を出さなかった人が来て発言したとしよう.「使い続けても,がんにはならないのか.それではなぜ,莫大な費用と時間,数多くの実験動物を使ってこんな試験を実施したのか.試験の規模を小さくできなかったのか.」—— このような後知恵は,試験開始時に最善最良の選択をして,最前線で治療薬開発に携わってきた医師や研究者を侮辱するものであり,何よりも亡くなった方々に対する冒涜でもある.
幸い,データベース提供機関や出版社が,無償でデータベース・電子ジャーナル・電子ブックを公開しており,COVID-19に関連する最新の情報を自由に学ぶことができる.錯綜する情報に惑わされないには研鑽に励む必要があり,それがポストコロナ時代を生き抜くアイデアを生み出す糧となると考える.
本コラムで意見に相当する部分は筆者の個人的見解を述べたもので,筆者の所属する組織の統一的見解ではありません.
著者紹介
澤田 浩隆
米国CMIC, Inc. 主任研究員.同志社大学大学院 生命医科学研究科修了.科研製薬に14年在籍,米国アラバマ大学バーミングハム校留学を経て現職.薬物動態,機器分析,橋渡し研究.博士(理学).
脚注
- *1. 米国国立公衆衛生研究所(NIH)と米国医薬食品局(FDA)が共同で提供する,実施中の治験および臨床研究のデータベース.FDAに医薬品申請するための臨床試験登録サイトとなっており,実質的な試験内容を無料で閲覧できる.試験成績が論文などで公表された場合,PubMedへのリンクが収録される.URL: https://clinicaltrials.gov/
- *2. Mizushima, T. (2014), ドラッグリポジショニング: 第1回なぜ今DRなのか, 実験医学, 32(14), 2277-81.
- *3. Mullard, A. (2020), 2019 FDA drug approvals. Nat Rev Drug Discov. 19(2), 79-84.
- *4. 佐藤哲男, 仮家公夫, 北田光一編(2010), 「医薬品トキシコロジー 改訂第4版」,南江堂.
- *5. Mehra, M. R., Desai, S. S., Ruschitzka, F., Patel, A. N. (2020), Hydroxychloroquine or chloroquine with or without a macrolide for treatment of COVID-19: a multinational registry analysis, Lancet. DOI: https://doi.org/10.1016/S0140-6736(20)31180-6
- *6. Takeda M. (2019), プロテアーゼ依存性ウイルス病原性発現機構とTMPRSS2, ウイルス, 69(1), 61-72.
- *7. Hoffmann M., Kleine-Weber H., Schroeder S., Kruger N., et al. (2020), SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor, Cell, 181(2), 271-280.e8.
- *8. Yamaguchi, T., Sano, K., Takakura, K., Saito, I., Shinohara, Y., Asano, T., Yasuhara, H. (1998), エブセレン(DR-3305)の急性期脳梗塞に対する臨床評価 — プラセボを対照とした二重盲検比較試験, 脳卒中, 20(6), 673-7.
- *9. Thangamani S., Younis W., Seleem M. N. (2015), Repurposing ebselen for treatment of multidrug-resistant staphylococcal infections, Scientific Report, 5, 11596. DOI: https://doi.org/10.1038/srep11596
- *10. Thangamani S., Eldesouky H. E., Mohammad H., Pascuzzi, P. E., Avramova, L., Hazbun, T. R., Seleem, M. N. (2017), Ebselen exerts antifungal activity by regulating glutathione (GSH) and reactive oxygen species (ROS) production in fungal cells, Biochim Biophys Acta Gen Subj. 1861(1 Pt A), 3002-10. DOI: 10.1016/j.bbagen.2016.09.029
- *11. Jin Z., Du X., Xu Y., Deng Y. (2020), Structure of M(pro) from SARS-CoV-2 and discovery of its inhibitors. Nature, pii: 10.1038/s41586-020-2223-y.
- *12. Yasuda K., Uchida N., Uchida E., Tuchiya T. (1995), 高齢患者における DR-3305 投与時の薬物動態, 臨床薬理, 26(1), 299-300.